Page 51 - No5
P. 51
MEDÚZÁK VILÁGÍTÓ FEHÉRJÉJE
egyik ilyen tulajdonság az, hogy a GFP nikák már rendelkezésre álltak. A
fehérje által kibocsátott fény nem függ a Caenorhabditis elegans nevű, tudományos
fehérje környezetétől. Vagyis nem alkal- körökben népszerű féreg DNS-ébe vitte be
mazható semmiféle detektálásra, szemben a GFP fehérjét kódoló génszakaszt oly
például a Ca ion-érzékeny aequorinnal. A módon, hogy a GFP a b-tubulin fehérjével
2+
másik tulajdonság, ami mára a fehérje leg- együtt fejeződött ki. Mivel a b-tubulin leg-
főbb előnyévé vált, egyszerűen értelmezhe- nagyobb mennyiségben a tapintást érzéke-
tetlen volt abban az időben. Akkoriban lő receptorokban található, a GFP is itt
ugyanis nem létezett még a genetikai jelent meg, zölden kirajzolva a
módosítás lehetősége, így Shimomuráék Caenorhabditis elegans 6 ilyen érzékelő
nem tudhatták, hogy a GFP fehérjét megfe- sejtjét. Ez volt az az áttörés, ami valójában
lelő genetikai beavatkozás révén más megalapozta a GFP térhódítását. Lehetővé
vált ugyanis kiválasztott fehérjék specifikus
Adott fehérjékhez kötve vizualizációja és monitorozása a hozzájuk HTTP://QUIPRONA.WORDPRESS.COM
kapcsolt GFP molekuláris fáklya révén.
követni tudjuk a
fehérjék megjelenési helyét és
akár esetleges mozgását is Hogyan világít?
szinte bármilyen élőlénybe Meglepő módon még ekkor sem volt
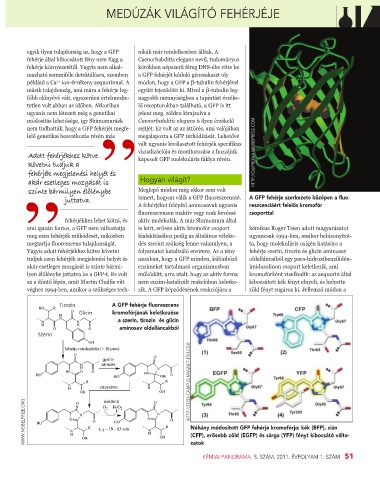
juttatva. ismert, hogyan válik a GFP fluoreszcenssé. A GFP fehérje szerkezete középen a fluo-
A fehérjéket felépítő aminosavak ugyanis reszcenciáért felelős kromofór
fluoreszcensen inaktív vagy csak kevéssé csoporttal
fehérjékhez lehet kötni, és aktív molekulák. A már Shimomura által
ami igazán fontos, a GFP nem változtatja is leírt, erősen aktív kromofór csoport kémikus Roger Tsien adott magyarázatot
meg ezen fehérjék működését, miközben kialakításához pedig az általános véleke- ugyancsak 1994-ben, amikor bebizonyítot-
megtartja fluoreszcens tulajdonságát. dés szerint szükség lenne valamilyen, a ta, hogy molekuláris oxigén hatására a
Vagyis adott fehérjékhez kötve követni folyamatot katalizáló enzimre. Az a tény fehérje szerin, tirozin és glicin aminosav
tudjuk ezen fehérjék megjelenési helyét és azonban, hogy a GFP minden, különböző oldalláncaiból egy para-hidroxibenzilidén-
akár esetleges mozgását is szinte bármi- enzimeket tartalmazó organizmusban imidazolinon csoport keletkezik, ami
lyen élőlénybe juttatva be a GFP-t. Ez volt működött, arra utalt, hogy az aktív forma kromofórként viselkedik: az aequorin által
az a döntő lépés, amit Martin Chalfie vitt nem enzim-katalizált reakcióban keletke- kibocsátott kék fényt elnyeli, és helyette
véghez 1994-ben, amikor a szükséges tech- zik. A GFP képződésének reakciójára a zöld fényt sugároz ki. Jellemző módon a
A GFP fehérje fluoreszcens
kromofórjának keletkezése
a szerin, tirozin és glicin
aminosav oldalláncakból
WWW.NOBELPRIZE.ORG HTTP://ZEISS-CAMPUS.MAGNET.FSU.EDU Néhány módosított GFP fehérje kromofórja: kék (BFP), cián
(CFP), erősebb zöld (EGFP) és sárga (YFP) fényt kibocsátó válto-
zatok
KÉMIAI PANORÁMA 5. SZÁM, 2011. ÉVFOLYAM 1. SZÁM 51