Page 54 - No8
P. 54
A VÉRALVADÁS GÁTLÁSA
gátolja az aktív X-es fak- vagy csak alig látható (nincs „kicsomagol-
tort, szükség van egy lineá- va”). Gyökeresen megváltozik a helyzet, ha
ris, öt monoszacharidból egy megfelelő erősen negatív töltésű
álló, több szulfátcsoportot pentaszacharid az antitrombin nagy pozi-
tartalmazó egységre, azaz tív töltéssűrűségű felületéhez kapcsolódik
egy megfelelően szulfatált és egy többlépéses konformációváltozást
pentaszacharidra. Ilyen indít el. Ennek következtében a laza asszo-
egységek szervezetünkben a ciációt egy szorosabb indukált illeszkedés
heparán szulfátokban vagy („induced fit”) követi. Az antitrombin
pl. a heparinban találhatók, pentaszacharid kötő régiójában és azok
melyek az antitrombin FXa környékén olyan szerkezeti változás megy
gátló képességét akár 1000 végbe, ami erősebb antitrombin-
szeresre is növelhetik. A pentaszacharid kölcsönhatást hoz létre.
heparán szulfátok elsősor- A pentaszacharid kötő régióban (amit
ban a természetes gátló heparin kötő régiónak is neveznek) bekö-
hatás növelésért felelősek, vetkező viszonylag kisebb konformációs
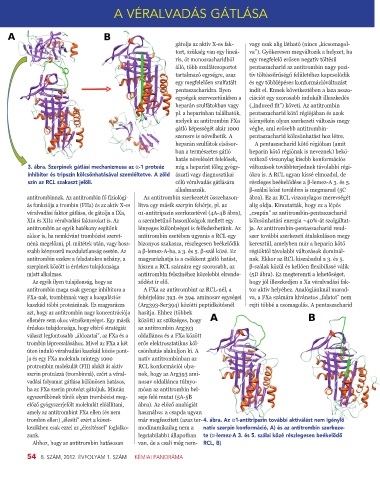
3. ábra. Szerpinek gátlási mechanizmusa az a-1 proteáz míg a heparint főleg gyógy- változások továbbterjednek távolabbi régi-
inhibítor és tripszin kölcsönhatásával szemléltetve. A zöld ászati vagy diagnosztikai ókra is. A RCL ugyan kissé elmozdul, de
szín az RCL szakaszt jelöli. célú véralvadás gátlására részleges beékelődése a β-lemez-A 3. és 5.
alkalmazzák. β-szálai közé továbbra is megmarad (5C
antitrombinnak. Az antitrombin fő fiziológi- Az antitrombin szerkezetét összehason- ábra). Ez az RCL viszonylagos merevségét
ás funkciója a trombin (FIIa) és az aktív X-es lítva egy másik szerpin fehérje, pl. az alig oldja. Kimutatták, hogy ez a lépés
véralvadási faktor gátlása, de gátolja a IXa, α1-antitripszin szerkezetével (4A-4B ábra), „csupán” az antitrombin-pentaszacharid
XIa és XIIa véralvadási faktorokat is. Az a szembetűnő hasonlóságok mellett egy kölcsönhatási energia ~40%-át szolgáltat-
antitrombin az egyik hatékony segítőnk lényeges különbséget is felfedezhetünk. Az ja. Az antitrombin-pentaszacharid rend-
akkor is, ha nemkívánt trombózist szeret- antitrombin esetében ugyanis a RCL egy szer további szerkezeti átalakuláson megy
nénk megelőzni, pl. műtétek után, vagy hosz- bizonyos szakasza, részlegesen beékelődik keresztül, amelyben már a heparin kötő
szabb kényszerű mozdulatlanság esetén. Az a β-lemez-A-ba, a 3. és 5. β-szál közé. Ez régióktól távolabbi változások dominál-
antitrombin ezekre a feladatokra néhány, a magyarázhatja is a csökkent gátló hatást, nak. Ekkor az RCL kiszabadul a 3. és 5.
szerpinek között is érdekes tulajdonsága hiszen a RCL számára egy szorosabb, az β-szálak közül és kellően flexibilissé válik
miatt alkalmas. antitrombin felszínéhez közelebbi elrende- (5D ábra). Ez megteremti a lehetőséget,
Az egyik ilyen tulajdonság, hogy az ződést ír elő. hogy jól illeszkedjen a Xa véralvadási fak-
antitrombin maga csak gyenge inhibítora a A FXa az antitrombint az RCL-nél, a tor aktív helyéhez. Analógiánknál marad-
FXa-nak, trombinnak vagy a koagulációs fehérjelánc 393. és 394. aminosav egységei va, a FXa számára kívánatos „falatot” nem
kaszkád többi proteázának. Ez magyarázza (Arg393-Ser394) közötti peptidkötésnél rejti többé a csomagolás. A pentaszacharid
azt, hogy az antitrombin nagy koncentrációja hasítja. Ehhez (többek
ellenére sem okoz vérzékenységet. Egy másik között) az szükséges, hogy
érdekes tulajdonsága, hogy eltérő stratégiát az antitrombin Arg393
választ legfontosabb „áldozatai”, az FXa és a oldallánca és a FXa között
trombin léprecsalásához. Mivel az FXa a két erős elektrosztatikus köl-
úton induló véralvadási kaszkád közös pont- csönhatás alakuljon ki. A
ja és egy FXa molekula mintegy 1000 natív antitrombinban az
protrombin molekulát (FII) alakít át aktív RCL konformációi olya-
,
ezért
a
ezért
,
)
a
(trombinná
szerin proteázzá (trombinná), ezért a véral-- nok, hogy az Arg393 ami-
éral
v
véral-
vadási folyamat gátlása különösen hatásos, nosav oldallánca túlnyo-
ha az FXa szerin proteázt gátoljuk. Miután móan az antitrombin bel-
meg
tűnik
olyan
olyan
egyszerűbbnek tűnik olyan trombózist meg-meg-- seje felé mutat (5A-5B
trombózist
trombózist
előző gyógyszerjelölt molekulát előállítani, ábra). Az előző analógiát
amely az antitrombint FXa ellen (és nem használva: a csapda ugyan
„élesíti”
„élesíti”
)
trombin ellen) „élesíti” ezért a követ-követ-követ-- már megfeszített (azaz ter-4. ábra. Az a1-antitripszin további aktiválást nem igénylő
ezért
a
a
követ
ezért
,
„élesítéssel”
antitrombin
szerkeze
az
A)
és
foglalko
csak
ezzel
az
kezőkben csak ezzel az „élesítéssel” foglalko-- modinamikailag nem a natív szerpin konformáció, A) és az antitrombin szerkeze- -
zunk. legstabilabb) állapotban te (a-lemez-A 3. és 5. szálai közé részlegesen beékelődő
Ahhoz, hogy az antitrombin hatásosan van, de a csali még nem- RCL, B)
54 8. SZÁM, 2012. ÉVFOLYAM 1. SZÁM KÉMIAI PANORÁMA