Page 53 - No8
P. 53
A VÉRALVADÁS GÁTLÁSA
jobban, mint hogy a sör legjelentősebb prote-
in alkotórésze az árpa szerpin. Ezidáig 36
emberi szerpin fehérjét azonosítottak. Bár
számos egyéb szerin proteáz inhibítorcsalád
létezik, magasabbrendű élőlényekben (külö-
nösen az embernél) ezek a legfontosabb szer-
vezeten belüli (ún. endogén) szerin proteáz
inhibítorok. A szerpinek szerkezetüknél fogva
különösen alkalmasak arra, hogy finoman
szabályozzák a szerin proteázok működését.
A szerpin család tagjai kb. 400 aminosavat
tartalmazó fehérjék, melyek egy fehérjelánc-
ból állnak. Annak ellenére, hogy a fehérje-
láncot alkotó aminosavak sorrendjét össze-
hasonlítva gyakran csak kevés hasonlóság
eddigi
eddigi adatok alap-
az
az
,
adatok alap-
fedezhető fel közöttük, az eddigi adatok alap-alap--
adatok alap
eddigi
adatok
ján nagyon hasonló háromdimenziós szerke-
zettel rendelkeznek. A szerkezet jellegzetes-
sége, hogy a csavarvonalú (helikális) szerke-
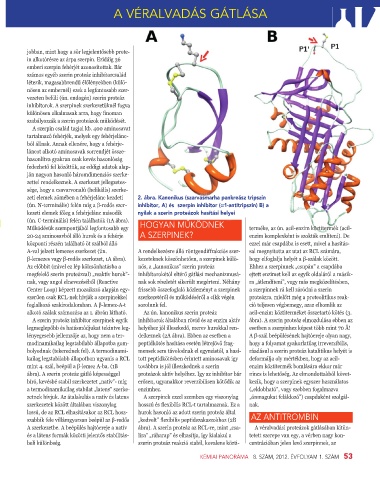
zeti elemek zömében a fehérjelánc kezdeti 2. ábra. Kanonikus (szarvasmarha pankreász tripszin
(ún. N-terminális) felén míg a β-redős szer- inhibítor, A) és szerpin inhibitor (a1-antitripszin) B) a
kezeti elemek főleg a fehérjelánc második nyílak a szerin proteázok hasítási helyei
(ún. C-terminális) felén találhatók (1A ábra). HOGYAN MŰKÖDNEK
Működésük szempontjából legfontosabb egy terméke, az ún. acil-enzim köztitermék (acil-
20-24 aminosavból álló hurok és a fehérje A SZERPINEK? enzim komplexként is szokták említeni). De
központi részén található öt szálból álló ezzel már csapdába is esett, mivel a hasítás-
A-val jelzett lemezes szerkezet (ún. A rendelkezésre álló röntgendiffrakciós szer- sal megnyitotta az utat az RCL számára,
a
,
a szerpinek külö
szerpinek
β-lemezes vagy β-redős szerkezet, 1A ábra). kezeteknek köszönhetően, a szerpinek külö-külö-- hogy elfoglalja helyét a β-szálak között.
Az előbbit (mivel ez lép kölcsönhatásba a nös, a „kanonikus” szerin proteáz Ehhez a szerpinnek „csupán” a csapdába
megfelelő szerin proteázzal) „reaktív hurok”- inhibítorokétól eltérő gátlási mechanizmusá- ejtett enzimet kell az egyik oldaláról a másik-
nak, vagy angol elnevezéséből (Reactive nak sok részletét sikerült megérteni. Néhány ra „átlendíteni”, vagy más megközelítésben,
Center Loop) képzett mozaikszó alapján egy- frissebb összefoglaló közleményt a szerpinek a szerpinnek rá kell záródni a szerin
szerűen csak RCL-nek hívják a szerpinekkel szerkezetéről és működéséről a cikk végén proteázra, mielőtt még a proteolitikus reak-
foglalkozó szakirodalomban. A β-lemez-A-t sorolunk fel. ció teljesen végbemegy, azaz elbomlik az
alkotó szálak számozása az 1. ábrán látható. Az ún. kanonikus szerin proteáz acil-enzim köztiterméket összetartó kötés (3.
A szerin proteáz inhibítor szerpinek egyik inhibítorok általában rövid és az enzim aktív ábra). A szerin proteáz elmozdulása ebben az
legmeglepőbb és hatásmódjukat tekintve leg- helyéhez jól illeszkedő, merev hurokkal ren- esetben a szerpinhez képest több mint 70 Å!
lényegesebb jellemzője az, hogy nem a ter- delkeznek (2A ábra). Ebben az esetben a A β-szál beépülésének hajtóereje olyan nagy,
modinamikailag legstabilabb állapotba gom- peptidkötés hasítása esetén létrejövő frag-- hogy a folyamat gyakorlatilag irreverzibilis,
létrejöv
ő
frag
távolodnak
egymástól,
el
a
bolyodnak (tekerednek fel). A termodinami- mensek sem távolodnak el egymástól, a hasí-- ráadásul a szerin proteáz katalitikus helyét is
hasí
kailag legstabilabb állapotban ugyanis a RCL tott peptidkötésben érintett aminosavak így deformálja oly mértékben, hogy az acil-
mint 4. szál, beépül a β-lemez A-ba. (1B továbbra is jól illeszkednek a szerin enzim köztitermék bomlására ekkor már
ábra). A szerin proteáz gátló képességgel proteázok aktív helyéhez. Igy az inhibítor bár nincs is lehetőség. Az elmondottakból követ-
bíró, kevésbé stabil szerkezetet „natív”- míg erősen, ugyanakkor reverzibilisen kötődik az kezik, hogy a szerpinek egyszer használatos
a termodinamikailag stabilat „latens” szerke- enzimhez. („eldobható”, vagy szebben fogalmazva
zetnek hívjuk. Az átalakulás a natív és latens A szerpinek ezzel szemben egy viszonylag „önmagukat feláldozó”) csapdaként szolgál-
szerkezetek között általában viszonylag hosszú és flexibilis RCL-t tartalmaznak. Ez a nak.
lassú, de az RCL elhasításakor az RCL hosz- hurok hasonló az adott szerin proteáz által
szabbik fele villámgyorsan beépül az β-redős „kedvelt” flexibilis peptidszakaszokhoz (2B AZ ANTITROMBIN
A szerkezetbe. A beépülés hajtóereje a natív ábra). A szerin proteáz az RCL-re, mint „csa- A véralvadási proteázok gátlásában kitün-
és a látens formák közötti jelentős stabilitás- lira” „ráharap” és elhasítja, így kialakul a tetett szerepe van egy, a vérben nagy kon-
beli különbség. szerin proteáz reakció stabil, kovalens közti- centrációban jelen levő szerpinnek, az
KÉMIAI PANORÁMA 8. SZÁM, 2012. ÉVFOLYAM 1. SZÁM 53