Page 32 - No23
P. 32
A KÉMIA ELMÉLETE
valószínűség hogyan változik az időben. mag közelében találjuk. Ez ugyanis függ lyák jelölésében szereplő szám nem egy-
VANNAK-E atomi zásai a valószínűségekben közvetlenül ra térrész tartozik, s ez r növekedésével „főkvantumszám”, ami nem lehet kisebb
attól is, hogy adott r távolsághoz mekko-
szerű sorszám, hanem az ún.
A hullámfüggvény esetleges előjelválto-
2-nél egy p-tipusú, 3-nál egy d-tipusú
nem jelennek meg, de a rendszer visel-
növekszik (arányos az r sugarú gömb
pálya esetén, stb. A főkvantumszám egy-
4r π felületével), úgyhogy a tartózkodási
kedése szempontjából igen fontos infor-
2
pályák molekulákban? mációt hordoznak, úgyhogy az előjeltől valószínűség az r = r távolságnál a leg- úttal jellemzi a pályák energiáját is, a
0
nagyobb. Ezzel kapcsolatban érdekes
nem lehet eltekinteni...
hidrogén speciális esetében igaz, hogy a
lehet megjegyezni, hogy még a kvantum-
2s és 2p pályák energiája, ill. a 3s, 3p és
Mi most csak az elektronokkal fogunk
foglalkozni, a magokat az egyszerűség
3d pályák energiája egyforma.
mechanika létrehozása előtt Bohr és
Egyelektronos rendszerek esetén a
kedvéért rögzített pontszerű töltések-
kísérletileg megfigyelt viselkedését úgy
ként kezeljük . A legegyszerűbb atom- Sommerfeld megkísérelték az atomok hullámfüggvény elsősorban az elektron
3
ban, a hidrogénatomban a hullámfügg- leírni, hogy a Naprendszer analógiájára három térbeli koordinátájától függ.
vény is viszonylag egyszerű. Különösen a mag körül keringő elektronokat téte- (Ezek lehetnek az x, z, y Descartes-
leztek fel, de a klasszikus mechanika koordináták, vagy pl. a magtól való r
egyenletei mellé bizonyos plusz feltétele- távolság és a relatív elfordulást leíró két
ket vezettek be. Ennek az elméletnek szög.) Bizonyos esetekben figyelembe
hidrogénatomban
a
lehet
értelmében a hidrogénatomban a lehet-- kell venni egy negyedik változót is, amit
a
séges legalacsonyabb energiájú elektron- az elektron „spinjének” neveznek. Ennek
pályára éppen egy r sugarú körpálya klasszikus analógiája az elektronnak a
0
adódott – innen a Bohr-féle rádiusz saját tengelye körül való forgása lehet
elnevezés. Ez a kapcsolat vezethetett (to spin = pörögni, forogni), de ez a
ahhoz a szóhasználathoz, hogy a kvan- szemléletes kép ugyanannyira tökélet-
tummechanikában az egyetlen elektron len, mint amennyire távoli az analógia a
koordinátáitól függő hullámfüggvénye- mag körüli zárt klasszikus pálya ill. az
kiterjedt
ket többnyire szintén pályáknak nevez- atom környezetében kiterjedt „elektron--
„elektron
„elektron-
zük, így beszélünk atompályákról, mole- felhőt” leíró hullámfüggvény között.
kulapályákról, stb. Mi is ebben az érte- (Sajnos a mikrovilág történéseit nem
lemben fogjuk használni a pálya szót a lehet szemléletes képekkel leírni.)
továbbiakban. Az elektron spinje kétféle értéket
Mint láttuk, a hidrogén alapállapotá- vehet fel, ezeket leginkább „felfelé” és
nak hullámfüggvénye csak az r távolság- „lefelé” mutató spineknek szokták
tól függ, attól nem, hogy milyen irány- nevezni – ezek klasszikus megfelelője az
ban van az elektron a magtól, vagyis ez lenne, hogy az óra járásával megegyező
az
-e
egy gömbszimmetrikus elektronpálya (a vagy ellentétes irányba forog-e az elekt-elekt--
az elekt
pálya szó fent említett értelmében). ron. Míg egyelektronos rendszerek ese-
Azonban irányfüggő (szögfüggő) pályák tén a spint csak ritkán (pl. mágneses tér
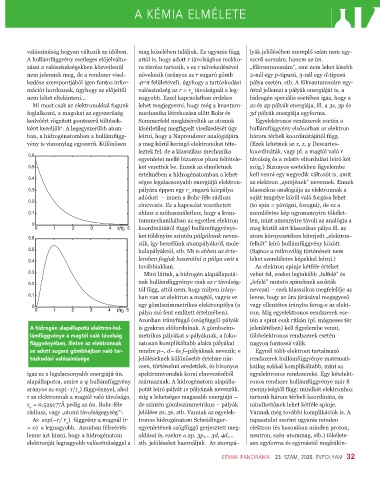
A hidrogén alapállapotú elektron-hul- is gyakran előfordulnak. A gömbszim- jelenlétében) kell figyelembe venni,
lámfüggvénye a magtól való távolság metrikus pályákat s-pályáknak, a foko- többelektronos rendszerek esetén
függvényében, illetve az elektronnak zatosan komplikáltabb alakú pályákat nagyon fontossá válik.
az adott sugarú gömbhéjban való tar- rendre p–, d– és f–pályáknak nevezik; e Egynél több elektront tartalmazó
tózkodási valószínűsége jelöléseknek különösebb értelme nin- rendszerek hullámfüggvénye matemati-
csen, történelmi eredetűek, és bizonyos kailag sokkal komplikáltabb, mint az
igaz ez a legalacsonyabb energiájú ún. spektrumvonalak korai elnevezéséből egyelektronos rendszereké. Egy kételekt-
alapállapotra, amire a ψ hullámfüggvény származnak. A hidrogénatom alapálla- ronos rendszer hullámfüggvénye már 8
arányos az exp(–r/r ) függvénnyel, ahol potát leíró pályát 1s pályának nevezzük, mennyiségtől függ: mindkét elektronhoz
0
r az elektronnak a magtól való távolsága, míg a lehetséges magasabb energiájú – tartozik három térbeli koordináta, és
r = 0.529177Å pedig az ún. Bohr-féle de szintén gömbszimmetrikus – pályák mindkettőnek lehet kétféle spinje.
0
rádiusz, vagy „atomi távolságegység” . jelölése 2s, 3s, stb. Vannak az egyelek-z egyelek- Vannak még további komplikációk is. A
4
Az exp(–r/ r ) függvény a magnál (r tronos hidrogénatom Schrödinger- tapasztalat szerint ugyanis minden
0
= 0) a legnagyobb. Azonban félreértés egyenletének szögfüggő gerjesztett meg- elektron (és hasonlóan minden proton,
lenne azt hinni, hogy a hidrogénatom oldásai is, ezekre a 2p, 3p,... 3d, 4d,... neutron, szén-atommag, stb.) tökélete-
elektronját legnagyobb valószínűséggel a stb. jelöléseket használjuk. Az atompá- sen egyforma és egymástól megkülön-
KÉMIAI PANORÁMA 23. SZÁM, 2020. ÉVFOLYAM 32