Page 37 - No29
P. 37
KÉT SZÉNATOM, EGY SZIGMA
Egy-elektronos C–C σ-kötés
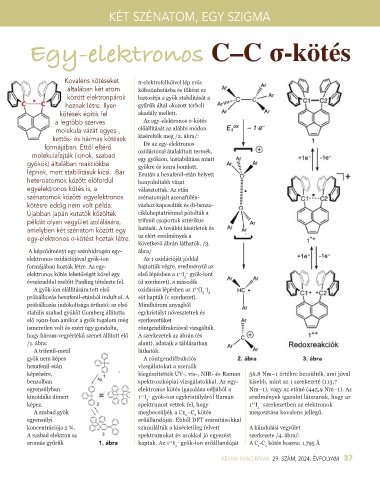
Kovalens kötéseket π-elektrofelhőivel lép erős
általában két atom kölcsönhatásba és főként ez
között elektronpárok biztosítja a gyök stabilitását a
hoznak létre. Ilyen gyűrűk által okozott térbeli
kötések építik fel akadály mellett.
a legtöbb szerves Az egy-elektronos σ-kötés
molekula vázát egyes-, előállítását az alábbi módon
kettős- és hármas kötések kísérelték meg /2. ábra/:
De az egy-elektronos
formájában. Ettől eltérő oxidációval átalakított termék,
molekulafajták (ionok, szabad egy gyökion, instabilitása miatt
gyökök) általában reakciókba gyökre és ionra bomlott.
lépnek, mert stabilitásuk kicsi. Bár Ezután a hexafenil-etán helyett
heteroatomok között előfordul bonyolultabb vázat
egyelektronos kötés is, a választottak. Az etán
szénatomok közötti egyelektronos szénatomjait acenaftilén-
kötésre eddig nem volt példa. vázhoz kapcsolták és di-benzo-
Újabban japán kutatók közöltek cikloheptatriénnel pótolták a
példát olyan vegyület izolálására, trifenil csoportok sztérikus
amelyben két szénatom között egy hatását. A további kisérletek és
egy-elektronos σ-kötést hoztak létre. az elért eredmények a
következő ábrán láthatók. /3.
A képződményt egy szénhidrogén egy- ábra/
elektronos oxidációjával gyök-ion Az 1 oxidációját jóddal
formájában hozták létre. Az egy- hajtották végre, eredményül az
elektronos kötés lehetőségét közel egy első lépésben a 1 I gyök-iont
–
•+
3
évszázaddal ezelőtt Pauling tételezte fel. (d szerkezet), a második
A gyök-ion elállítására tett első oxidációs lépésben az 1 (I )
–
2+
3
2
próbálkozás hexafenil-etánból indult el. A sót kapták (c szerkezet).
próbálkozás indokoltsága érthető; az első Mindhárom anyagból
stabilis szabad gyököt Gomberg állította egykristályt növesztettek és
elő 1900-ban amikor a gyök fogalom még szerkezetüket
ismeretlen volt és ezért úgy gondolta, röntgendiffrakcióval vizsgálták.
hogy három-vegyértékű szenet állított elő A szerkezetek az ábrán (és
/1. ábra: alant), adataik a táblázatban
A trifenil-metil láthatók.
gyök nem képes A röntgendiffrakciós 2. ábra 3. ábra
hexafenil-etán vizsgálatokat a szerzők
képzésére, kiegészítették UV-, vis-, NIR- és Raman 56.8 Nm−1 értékre becsülték, ami jóval
benzolban spektroszkópiai vizsgálatokkal. Az egy- kisebb, mint az 1 szerkezeté (113,7
egyensúlyban elektronos kötés igazolása céljából a Nm−1), vagy az etáné (445,9 Nm−1). Az
kinoidális dimert 1 I gyök-ion egykristályáról Raman eredmények igazolni látszanak, hogy az
–
•+
3
képez. spektrumot vettek fel, hogy 1 I szerkezetben az elektronok
–
•+
3
A szabad gyök megbecsüljék a C1 –C kötés megosztása kovalens jellegű.
2
2
egyensúlyi erőállandóját. Ebből DFT számításokkal
koncentrációja 2 %. szimulálták a kisérletileg felvett A kiindulási vegyület
A szabad elektron az spektrumokat és azokkal jó egyezést szerkezete /4. ábra/:
aromás gyűrűk 1. ábra kaptak. Az 1 I gyök-ion erőállandóját A C -C kötés hossza: 1,795 Å
–
•+
1
2
3
KÉMIAI PANORÁMA 29. SZÁM, 2024. ÉVFOLYAM 37