Page 39 - No30
P. 39
NMR SPEKTROSZKÓPIA
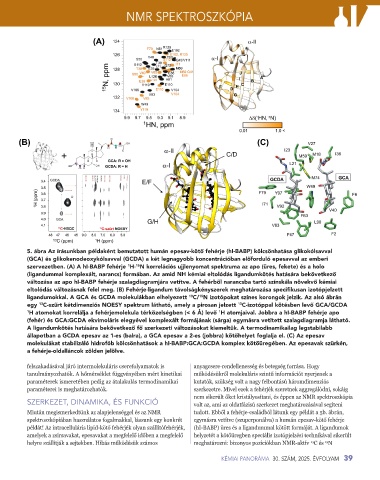
5. ábra Az írásunkban példaként bemutatott humán epesav-kötő fehérje (hI-BABP) kölcsönhatása glikokólsavval
(GCA) és glikokenodeoxykólsavval (GCDA) a két legnagyobb koncentrációban előforduló epesavval az emberi
15
szervezetben. (A) A hI-BABP fehérje H- N korrelációs ujjlenyomat spektruma az apo (üres, fekete) és a holo
1
(ligandummal komplexált, narancs) formában. Az amid NH kémiai eltolódás ligandumkötés hatására bekövetkező
változása az apo hI-BABP fehérje szalagdiagramjára vetítve. A fehérből narancsba tartó színskála növekvő kémiai
eltolódás változásnak felel meg. (B) Fehérje-ligandum távolságkényszerek meghatározása specifikusan izotópjelzett
ligandumokkal. A GCA és GCDA molekulákban elhelyezett C/ N izotópokat színes korongok jelzik. Az alsó ábrán
13
15
13
egy C-szűrt kétdimenziós NOESY spektrum látható, amely a pirosan jelzett C-izotóppal kötésben levő GCA/GCDA
13
1 H atomokat korrelálja a fehérjemolekula térközelségben (< 6 Å) levő H atomjaival. Jobbra a hI-BABP fehérje apo
1
(fehér) és GCA:GCDA ekvimoláris elegyével komplexált formájának (sárga) egymásra vetített szalagdiagramja látható.
A ligandumkötés hatására bekövetkező fő szerkezeti változásokat kiemeltük. A termodinamikailag legstabilabb
állapotban a GCDA epesav az 1-es (balra), a GCA epesav a 2-es (jobbra) kötőhelyet foglalja el. (C) Az epesav
molekulákat stabilizáló hidrofób kölcsönhatások a hI-BABP:GCA:GCDA komplex kötőüregében. Az epesavak szürkén,
a fehérje-oldalláncok zölden jelölve.
felszakadásával járó intermolekuláris cserefolyamatok is anyagcsere-rendellenesség és betegség forrása. Hogy
tanulmányozhatók. A hőmérséklet függvényében mért kinetikai működésükről molekuláris szintű információt nyerjenek a
paraméterek ismeretében pedig az átalakulás termodinamikai kutatók, szükség volt a nagy felbontású háromdimenziós
paraméterei is meghatározhatók. szerkezetre. Mivel ezek a fehérjék szeretnek aggregálódni, sokáig
nem sikerült őket kristályosítani, és éppen az NMR spektroszkópia
SZERKEZET, DINAMIKA, ÉS FUNKCIÓ volt az, ami az oldatfázisú szerkezet meghatározásával segíteni
Miután megismerkedtünk az alapjelenséggel és az NMR tudott. Ebből a fehérje-családból látunk egy példát a 5b. ábrán,
spektroszkópiában használatos fogalmakkal, lássunk egy konkrét egymásra vetítve (szuperponálva) a humán epesav-kötő fehérje
példát! Az intracelluláris lipid-kötő fehérjék olyan szállítófehérjék, (hI-BABP) üres és a ligandummal kötött formáját. A ligandumok
amelyek a zsírsavakat, epesavakat a megfelelő időben a megfelelő helyzetét a kötőüregben speciális izotópjelzési technikával sikerült
helyre szállítják a sejtekben. Hibás működésük számos meghatározni: bizonyos pozíciókban NMR-aktív C és N
13
15
KÉMIAI PANORÁMA 30. SZÁM, 2025. ÉVFOLYAM 39