Page 38 - No30
P. 38
NMR SPEKTROSZKÓPIA
egymáshoz viszonyított iránya, és ezáltal molekulaszegmensek,
alegységek relatív helyzete.
IZGŐ-MOZGÓ MOLEKULÁK
Bár sok esetben golyó- és pálcika modellel ábrázoljuk őket, a
molekulák nem merev képződmények, hanem nagyon is
mozgékony rendszerek, amelyekben különböző időskálán zajló,
különböző amplitúdójú mozgások rakódnak egymásra. Az NMR
spektroszkópia egyik előnye, hogy nagyon széles időskálán képes
információt nyújtani a gyakran a molekulák funkcionális
működésében is fontos szerepet játszó belső mozgásokról. Ilyen
lehet például egy oldalláncforgás, egy gyűrűs molekula
inverziója, vagy egy fehérjemolekulában zajló konformációs
fluktuáció. A belső molekuláris mozgások NMR spektroszkópiai
vizsgálata az esetek döntő többségében relaxációs mérések
segítségével történik. Ennek során a vizsgálandó rendszert
rádiófrekvenciás impulzusok alkalmazásával kibillentjük az
egyensúlyi állapotból, majd követjük, amint az a magasabb
energiájú (gerjesztett) állapotból az alapállapotba visszatér. A
mérések általános alapja, hogy a molekulában zajló mozgások a
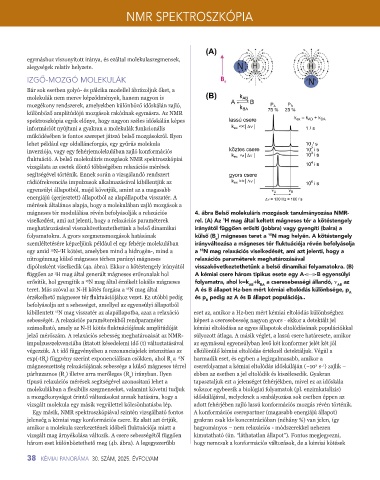
mágneses tér modulálása révén befolyásolják a relaxációs 4. ábra Belső molekuláris mozgások tanulmányozása NMR-
viselkedést, ami azt jelenti, hogy a relaxációs paraméterek rel. (A) Az H mag által keltett mágneses tér a kötéstengely
1
meghatározásával visszakövetkeztethetünk a belső dinamikai irányától függően erősíti (jobbra) vagy gyengíti (balra) a
folyamatokra. A gyors szegmensmozgások hatásának külső (B ) mágneses teret a N mag helyén. A kötéstengely
15
o
szemléltetésére képzeljünk például el egy fehérje molekulában irányváltozása a mágneses tér fluktuációja révén befolyásolja
egy amid N- H kötést, amelyben mind a hidrogén-, mind a a N mag relaxációs viselkedését, ami azt jelenti, hogy a
15
1
15
nitrogénmag külső mágneses térben parányi mágneses relaxációs paraméterek meghatározásával
dipólusként viselkedik (4a. ábra). Ekkor a kötéstengely irányától visszakövetkeztethetünk a belső dinamikai folyamatokra. (B)
függően az H mag által generált mágneses erővonalak hol A kémiai csere három tipikus esete egy A B egyensúlyi
1
erősítik, hol gyengítik a N mag által érzékelt lokális mágneses folyamatra, ahol k=k +k a cseresebességi állandó, ѵ az
15
AB
AB
BA
teret. Más szóval az N-H kötés forgása a N mag által A és B állapot Hz-ben mért kémiai eltolódás különbsége, p A
15
érzékelhető mágneses tér fluktuációjához vezet. Ez utóbbi pedig és p pedig az A és B állapot populációja..
B
befolyásolja azt a sebességet, amellyel az egyensúlyi állapotból
kibillentett N mag visszatér az alapállapotba, azaz a relaxáció eset az, amikor a Hz-ben mért kémiai eltolódás különbséghez
15
sebességét. A relaxációs paraméterekből rendparaméter képest a cseresebesség nagyon gyors - ekkor a detektált jel
számolható, amely az N-H kötés fluktuációjának amplitúdóját kémiai eltolódása az egyes állapotok eltolódásának populációkkal
jelző mérőszám. A relaxációs sebesség meghatározását az NMR- súlyozott átlaga. A másik véglet, a lassú csere határesete, amikor
impulzusszekvenciába iktatott késedelemi idő (t) változtatásával az egymással egyensúlyban levő két konformer jelét két jól
végezzük. A t idő függvényében a rezonanciajelek intenzitása az elkülönülő kémiai eltolódás értéknél detektáljuk. Végül a
exp(-tR ) függvény szerint exponenciálisan csökken, ahol R a N harmadik eset, és egyben a legizgalmasabb, amikor a
15
i
i
mágnesezettség relaxációjának sebessége a külső mágneses térrel cserefolyamat a kémiai eltolódás időskáláján (~10 s- ) zajlik –
3
1
párhuzamos (R ) illetve arra merőleges (R ) irányban. Ilyen ebben az esetben a jel eltolódik és kiszélesedik. Gyakran
1
2
típusú relaxációs mérések segítségével azonosítani lehet a tapasztaljuk ezt a jelenséget fehérjékben, mivel ez az időskála
molekulákban a flexibilis szegmenseket, valamint követni tudjuk sokszor egybeesik a biológiai folyamatok (pl. enzimkatalízis)
a mozgékonyságot érintő változásokat annak hatására, hogy a időskálájával, melyeknek a szabályozása sok esetben éppen az
vizsgált molekula egy másik vegyülettel kölcsönhatásba lép. adott fehérjében zajló lassú konformációs mozgás révén történik.
Egy másik, NMR spektroszkópiával szintén vizsgálható fontos A konformációs cserepartner (magasabb energiájú állapot)
jelenség a kémiai vagy konformációs csere. Ez alatt azt értjük, gyakran csak kis koncentrációban (néhány %) van jelen, így
amikor a molekula szerkezetének időbeli fluktuációja miatt a hagyományos – nem relaxációs - módszerekkel nehezen
vizsgált mag árnyékolása változik. A csere sebességétől függően kimutatható (ún. “láthatatlan állapot”). Fontos megjegyezni,
három eset különböztethető meg (4b. ábra). A legegyszerűbb hogy nemcsak a konformációs változások, de a kémiai kötések
38 KÉMIAI PANORÁMA 30. SZÁM, 2025. ÉVFOLYAM