Aminosavakat és nukleobázisokat mutattak ki a Bennu aszteroida mintáiban.

A
NASA Goddard Űrrepülési Központjának munkatársai, Daniel Glavin és
Jason Dworkin által vezetett nemzetközi kutatócsoport, ammóniában és
nitrogénben gazdag oldható szerves anyagok kimutatásáról számolt be a
Bennu-aszteroida mintákban. A Nature Astronomy folyóiratban közzétett
eredmények betekintést nyújtanak az aszteroidák kémiájába és a földi
élet eredetében betöltött lehetséges szerepükbe.
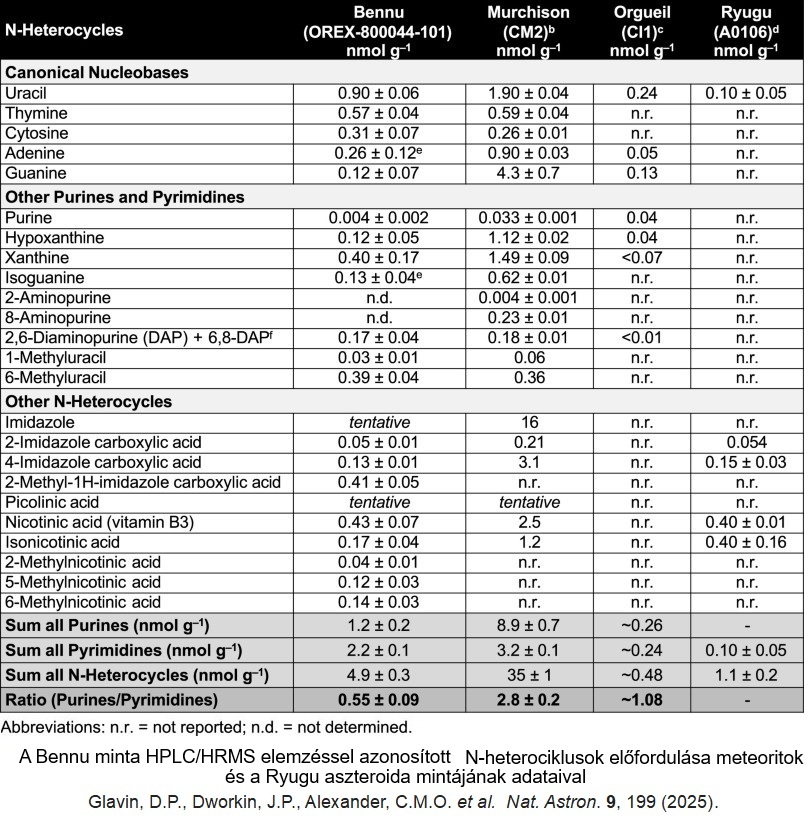
A szerzők kimutatták, hogy a Bennu minták illékonyak,
gazdagabbak, szénben, nitrogénben és ammóniában,
mint a Ryugu aszteroida és a legtöbb meteorit mintái. A számos aminosav (köztük 14
a földi biológiában használt 20-ból), aminok, formaldehid, karbonsavak, hangyasav,
ecetsav, policiklusos aromás szénhidrogének mellett, a DNS-ben és RNS-ben
előforduló mind az öt nukleobázist a citozint, guanint, adenint,
timin és uracilt is detektálták.
Minden királis
nem-fehérje aminosav racém vagy közel az volt, ami azt jelenti, hogy a földi élet balkezes kiralitása nem feltétlenül a
becsapódások által szállított prebiotikus molekulák torzításának
köszönhető. Ez a felfedezés arra utal, hogy az élet építőkövei gyakoribbak
lehetnek az univerzumban, mint azt korábban gondolták.
Az aminosavak és más oldható szerves anyagok relatív mennyisége arra
utal, hogy alacsony hőmérsékletű reakciók révén
képződnek és módosulnak, esetleg NH3-ban gazdag folyadékokban. A Bennu
szülőaszteroidája a külső Naprendszerben
keletkezhetett, ahol az ammóniajég stabil volt. A 15N izotóp dúsulása
azt jelzi, hogy az
ammónia és más N-tartalmú oldható molekulák hideg molekulafelhőben vagy a külső protoplanetáris korongban képződnek.
D.P.Dworkin et al., Nat.Astron. 9 199 (2125)
http://doi.org/10.1038/s41550-02472-9
------------------------------------------------------------------------------------------------------------------------
2024 a legmelegebb év volt 1850 óta
A
kaliforniai székhelyű Berkeley Earth nonprofit kutatószervezet arra a
következtetésre jutott, hogy 2024 volt a legmelegebb év a Földön 1850
óta, egyértelmű és végleges különbséggel meghaladva a korábbi, 2023-ban
felállított rekordot. (berkeleyearth.org). Az éves globális átlaghőmérséklet több mint 1,6 C fokkal meghaladta az1850-1900 közötti átlagot.
Az elmúlt tíz év volt a tíz legmelegebb év, amelyet a műszeres feljegyzésekben megfigyeltek. A
szárazföldi területek általában kétszer akkora felmelegedést mutatnak,
mint az óceánok. Az 1850-1900 közti átlaghoz képest a szárazföldi átlag
2024-ben 2,28 C fokkal, az óceániok hőmérséklete pedig a tengeri jeges
régiók nélkül 1.15 C fokkal nött meg.
|
2025. július 26-án az Alföld délkeleti részén
40,0 foknál is magasabbra emelkedett a hőmérséklet. Egy 104 éves,
országos napi maximum hőmérséklet rekord dőlt meg, 0,9 fokkal. Az új
legmagasabb napi maximum hőmérsékleti országos rekord 41,3 fok, melyet
Sarkad Malomfok állomásunkon mértek. A korábbi rekord 40,4 fok volt,
melyet Szerep állomásukon regisztráltak, 1921-ben. (Hungaromet)
|