Page 23 - No30
P. 23
GYÓGYÍTÓ NEMESFÉM
hullámhosszal (< 1 nm), akkor a folytonos (λ em = 450–480 nm) figyelhető meg, míg,
vezetési sáv(ok) diszkrét energiaszintekre ha a klasztert már több atom alkotja (pl.
hasad(nak) fel és így a NCs inkább 10–13 db) akkor az emisszió a zöld
mutatnak molekuláris viselkedést, hullámhossz tartományban (λ em = 490–
mintsem plazmonikus tulajdonságot (4. 510) jelentkezik. Ahogyan az 5. ábra is
ábra). mutatja, növelve a klasztert alkotó
A másik értelmezés a „charge transfer” atomok számát (> 25 db) vörös
(töltésátviteli folyamat) a fém klaszterek emisszióival rendelkező NCs is
felületén kötődő (bio)ligandumok és a előállíthatóak.
fémmag közötti kölcsönhatás (e -átmenet) A PL élettartam vonatkozásában
-
következtében, ami lehet ún. ligand-to- általános megállapítások nem tehetőek,
metal charge transfer (LMCT, ligandum- de az Au NCs esetén kijelenthető, hogy a
fém töltéstranszfer) ill. ligand-to-metal- néhány atomos NCs nanoszekundumos
metal charge transfer (LMMCT, átlagos élettartalommal rendelkeznek,
ligandum-fém-fém töltéstranszfer). Mára míg a nagyobb, vörös emisszióval
ezt a kétféle értelmezést együtt kezelik, rendelkező NCs mikroszekundumos
hiszen mindkettőnek meghatározó élettartama a jellemző érték, mely átlagos
hozzájárulása van a karakterisztikus élettartam értékek több komponensre
fluoreszcenciához. A PL-át számos egyéb bonthatóak a fentebb említett LCMT és
tényező is befolyásolja, úgy, mint a LCMMT átmenetek alapján. Az
klasztert alkotó atomok száma, az élettartalom mellett a kvantumhatásfok
elektronban gazdag donorcsoportok (S, N, (QY(%)) is meghatározó paraméter; Au
P) jelenléte a fémmag felületén, a fém NCs vonatkozásában a 8 – 10 % már
oxidációs állapota (Au , Au ), de az kiemelkedő értéknek számít.
+
0
oldószer, a pH és a hőmérséklet is.
Számos publikáció igazolja, hogy a ÍGÉRETES LEHETŐSÉGEK
néhány atomot tartalmazó klaszterek (pl.: Egyedi szerkezeti és főként hangolható
Au -Au ) esetén intenzív kék emisszió optikai sajátságaiknak köszönhetően
8
3
orvosbiológiai területen is egyre inkább
előtérbe kerülnek ezen nemesfémalapú
NPs és NCs. Az Au NPs hatékony
hordozóként szolgálhatnak gyógyszerek,
DNS vagy RNS molekulák célzott
daganatsejtekhez történő szállításában,
növelve a terápiás hatékonyságot és
csökkentve a mellékhatásokat, emellett
képesek fokozni a sugárterápia
hatékonyságát a tumorban történő
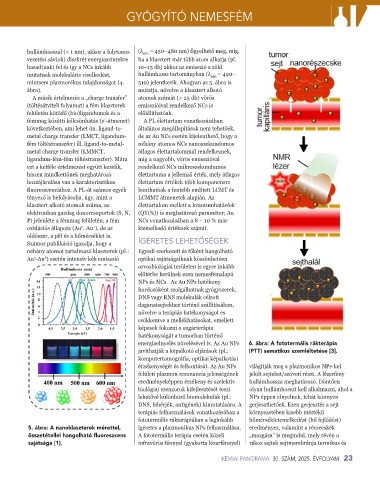
energiaelnyelés növelésével is. Az Au NPs 6. ábra: A fototermális rákterápia
javíthatják a képalkotó eljárások (pl.: (PTT) sematikus szemléltetése [3].
komputertomográfia, optikai képalkotás)
érzékenységét és felbontását. Az Au NPs világítják meg a plazmonikus NPs-kel
felületi plazmon rezonancia jelenségének jelölt sejteket/szöveti részt. A lézerfény
eredményeképpen érzékeny és szelektív hullámhossza meghatározó. Döntően
biológiai szenzorok kifejlesztését teszi olyan hullámhosszt kell alkalmazni, ahol a
lehetővé különböző biomolekulák (pl.: NPs éppen elnyelnek, tehát könnyen
DNS, fehérjék, antigének) kimutatására. A gerjeszthetőek. Ezen gerjesztés a sejt
terápiás felhasználások vonatkozásában a környezetében kisebb mértékű
fototermális rákterápiában a leginkább hőmérsékletemelkedést (hő fejlődést)
5. ábra: A nanoklaszterek mérettel, ígéretes a plazmonikus NPs felhasználása. eredményez, valamint a récsecskék
összetétellel hangolható fluoreszcens A fototermális terápia esetén közeli „mozgása” is megindul, mely révén a
sajátsága [1]. infravörös fénnyel (gyakorta lézerfénnyel) rákos sejtek sejtmembránja termikus és
KÉMIAI PANORÁMA 30. SZÁM, 2025. ÉVFOLYAM 23